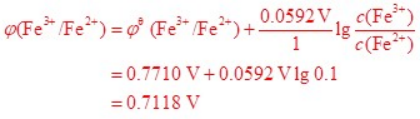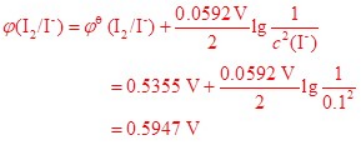在 298.15 K 时,将反应 2 I– {aq} + 2 Fe3+ {aq} = I2 {s} + 2 Fe2+ {aq} 组成原电池,其中φӨ {I2/I–} = 0.5355 V,φӨ {Fe3+/Fe2+} = 0.7710 V
写出正、负电极的电极反应|
计算说明标准状态下,反应能否正向进行|
计算当 c {I–} = 0.1 mol∙L–1、c {Fe3+} = 0.1 c {Fe2+},其余物质均为标准状态时,原电池的电动势。
1正极:Fe3+ + e- = Fe2+ 负极: I2+ 2e- = 2I-
2εӨ = φӨ{Fe3+/Fe2+} - φӨ{I2/I-} = 0.7710 V – 0.5355 V = 0.2355 V
Ө > 0,所以反应正向进行
Ε
{3}